Helicobacter pylori представляет собой болезнетворную бактерию, которая обитает в основном в пилорическом (антральном) отделе желудка.
На фото ниже видно, что микроорганизм имеет форму спирали, к которой прикреплены жгутики. Такое строение помогает ей крепко держаться за стенки пищеварительного органа, передвигаться по нему вместе со слизью и существовать в кислой среде, которую многие патогенные микроорганизмы не переносят и гибнут.
Попадая в организм человека, хеликобактер пилори вызывает опасное заболевание – хеликобактериоз. Бактерии стремительно размножаются, и в процессе своей жизнедеятельности производят много токсинов, разъедающих слизистую оболочку желудка (двенадцатиперстной кишки), а затем и сами стенки пищеварительного органа. Подобное воздействие опасно тем, что создаёт благоприятную среду для гастрита, язвы, а также злокачественных новообразований.
Что это такое?
Хеликобактер пилори — это всего лишь бактерия, которую обнаруживаются у пациентов с различными заболеваниями желудка и кишечника, двенадцатиперстной кишки в частности.
Что касается названия бактерии хеликобактер пилори (Helicobacter pylori), то оно совсем не случайно. Одна его часть, «пилори», указывает на основное место обитания бактерии — пилорический отдел желудка, а вторая часть, «хелико», характеризует форму бактерии: винтообразная, спиралевидная.
Ранее в медицине считалось, что микроорганизма, способного выжить в кислой, соляной среде желудка в принципе не существует. Но тогда медики не подозревали о существовании хеликобактерии. Хеликобактер пилори был открыт только в 1979 году ученым из Австралии Робином Уорреном. Совместно с ученым коллегой доктором Барри Маршаллом «первооткрывателям» удалось вырастить данную бактерию хеликобактер в лабораторных условиях. Тогда они только предположили, что именно она является виновницей гастритов и язв желудка, а вовсе не неправильное питание или стрессы, как считалось ранее.
В попытке подтвердить правоту своей догадки, Барри Маршалл провел эксперимент на себе, выпив содержимое чашки Петри, в которой культивировался хеликобактер пилори. Спустя буквально несколько дней у ученого обнаружился гастрит. Вылечить его удалось, принимая на протяжении двух недель метронидазол. И уже в 2005 году авторы этого открытия ученые за свое открытие получили в области медицины Нобелевскую премию. Весь мир признал, что язвы и гастриты, со всеми вытекающими и сопутствующими заболеваниями, появляются именно из-за хеликобактерии.
ОткрытиеHelicobacter pylori
История одного из величайших открытий XX века началась в 1979 году, когда рядовой врач Барри Маршалл получил должность в крупнейшей клинике Западной Австралии — Королевском госпитале Перта. Во время одного из внутренних тренингов, которые организовывались руководством клиники, Маршалл познакомился с талантливым патологоанатомом Робином Уорреном. Тот как раз занимался изучением этиологии гастрита и сумел увлечь нового товарища. Уже в 1981 году дуэт Маршалла и Уоррена обнаружил в слизистой больных гастритом спиральную бактерию. Исследователям понадобился год, чтобы разработать гипотезу, связывающую крепкими узами «новорожденную» Helicobacter pylori с язвенной болезнью и раком желудка.
Однако дорога к успеху редко бывает устлана розами и лилиями. На первых порах теория Маршалла и Уоррена встретила лишь ухмылки коллег да скепсис маститых ученых. В 1998 году, когда трудности были уже позади, Маршалл написал: «Тогда каждый был против меня. Но я знал, что прав». Упорные австралийцы пробивали дорогу своему открытию, не жалея ни времени, ни сил, ни здоровья.
После неудачной попытки заразить хеликобактерной инфекцией поросят Маршалл решился на эксперимент, достойный великих исследователей. Он выпил содержимое чашки Петри, в которой культивировались H. pylori, и приготовился к ожиданию. Ученый надеялся, что через год или чуть больше у него смогут диагностировать язвенную болезнь желудка, и он наконец докажет очевидную причинно-следственную связь. Однако события не заставили себя долго ждать.
Спустя три дня после начала эксперимента мать Маршалла заметила, что у сына стало дурно пахнуть изо рта. Вскоре к симптомам присоединилась тошнота и рвота, а всего лишь спустя восемь дней после отчаянного поступка эндоскопическое исследование подтвердило: в желудке врача начался острый гастрит, а из мазка со слизистой была культивирована H. pylori. На 14‑й день эксперимента Маршалл начал принимать антибиотики. После курса лечения было зафиксировано полное выздоровление.
В 1985 году подробности эксперимента появились на страницах Медицинского журнала Австралии. Кстати, вскоре эта статья приобрела всемирную известность и стала самой цитируемой за всю историю издания. Казалось бы, доказательства очевидны и дело — за малым. Однако до полного признания оставалось еще почти десятилетие.
Таблица 2.
Препараты для эрадикационной терапии(международные и торговые названия)
| Группа | Международное название | Торговое название |
| антибиотики пенициллины | амоксициллин | Оспамокс, Флемоксин Солютаб, Хиконцил |
| антибиотики макролиды | кларитромицин | лабакс, Клабакс ОД, Кларитромицин-Зентива, Кларитромицин Пфайзер, Клацид, Клацид СР, Фромилид, Фромилид Уно |
| антибиотики тетрациклины | тетрациклин | Тетрациклин |
| ингибиторы протонной помпы | омепразол | Зероцид, Лосек, Омез, Омизак, Ортанол, Ромесек, Улкозол, Ультоп, Хелицид, Цисагаст |
| лансопразол | Ланзабел, Ланзап, Ланзоптол, Ланцид, Лоэнзар-сановель, Эпикур | |
| рабепразол | Берета, Золиспан, Зульбекс, Нофлюкс, Онтайм, Париет, Рабелок, Хайрабезол | |
| пантопразол | Зипантола, Контролок, Кросацид, Нольпаза, Пантаз, Панум, Пептазол, Пиженум-сановель, Пулореф, Санпраз, Ультера | |
| эзомепразол | Нексиум, Нео-зекст, Эманера | |
| противомикробные и противопротозойные средства | метронидазол | Клион, Метрогил, Метронидазол, Трихопол, Флагил, Эфлоран |
| гастропротекторы | висмута трикалия дицитрат | Де-Нол, Новобисмол |
Как можно заразиться?
Инфицирование происходит при передаче бактерий от одного человека к другому фекально-оральным или орально-оральным путем. Кроме этого, существуют гипотезы о передаче это бактерии от кошек к человеку, а также об их механическом переносе мухами.
Чаще всего заражение происходит в детском возрасте. Самым вероятным путем заражения считается передача хеликобактер пилори от человека к человеку, которая может происходить тремя способами:
- Ятрогенный (обусловленный медицинскими процедурами) путь. При этом пути заражение обусловлено использованием эндоскопического или другого медицинского инструмента, который контактировал со слизистой оболочкой желудка инфицированного пациента, у другого человека.
- Фекально-оральный путь. H. pylori выделяются со стулом зараженных людей. Источником инфицирования могут быть загрязненные каловыми массами вода или продукты питания.
- Орально-оральный путь. Существуют данные, что хеликобактер пилори может находиться в ротовой полости. Поэтому возможна передача бактерий при совместном использовании столовых приборов и зубных щеток, поцелуях.
Публикации
В гастроэнтерологической практике заболевания желудка и двенадцатиперстной кишки у детей являются наиболее распространенными. Значительное место в развитии воспалительных изменений слизистой оболочки принадлежит инфекции Helicobacter pylori (НР).
Заражение HР происходит преимущественно в детском возрасте, и без соответствующего лечения персистенция бактерий остается пожизненной. По данным ряда авторов инфицированность НР детей старше 7 лет с болевым абдоминальным и/или диспепсическим синдромом достигает 80%.
В зависимости от вирулентных свойств микроорганизма и генетических особенностей макроорганизма исходы инфицирования H. pylori могут быть различны. Длительная персистенция микроорганизма может приводить к развитию атрофического мультифокального гастрита, аденокарциномы желудка, MALT-лимфомы. В последние годы отмечается тенденция к увеличению случаев тяжелых изменений в желудке, приводящих к развитию серьезных осложнений, что значительно ухудшает общее состояние ребенка и требует длительного и дорогостоящего лечения.
Стандарты эрадикации инфекции Helicobacter pylori, принятые 3-м Маастрихтским Консенсусом в 2005г., относятся к необходимым мероприятиям упреждающего реагирования на рост резистентности Н. pylori к рекомендованным ранее схемам. Согласно современным положениям, 14-дневная продолжительность лечения является более эффективной в сравнении с 7-дневной. В тех случаях, когда качественными “локальными” исследованиями продемонстрирована его эффективность, может использоваться 7-дневный протокол, который включает ингибитор протонной помпы (ИПП) в стандартной дозировке 2 раза в день + кларитромицин 500 мг 2 раза в день + амоксициллин 1000 мг 2 раза в день (или метронидазол по 500 мг 2 раза). В соответствии с современными положениями, лечение НР-инфекции должно быть экономически доступным для больного, хорошо переноситься, количество вылечившихся пациентов составлять не менее 80%.
Комбинированным препаратом, зарегистрированным в Республике Беларусь, соответствующим рекомендациям EHPSG — 2005, является Пептипак (Peptiрac). В одной упаковке имеется семь блистеров, каждый из которых содержит суточный набор лекарственных средств для проведения эрадикации 1-й линии: омепразол (Омепрал) 20 мг × 2 раза, кларитромицин (Кларикар) 500 мг × 2 раза, амоксициллин (Амоксикар) 1000 мг × 2 раза в день. Все препараты принимают за 20-30 минут до еды. Удобство в распределении суточной дозы позволяет соблюдать приверженность пациента и его родителей к терапии.
Терапия первой линии рекомендована, если резистентность наиболее распространенных штаммов H.pylori к кларитромицину в данном регионе не превышает 10-15%, а к метронидазолу – 40%. В терапии первой линии Маастрихт-3 предполагает возможность замены амоксициллина на метронидазол (500 мг × 2 раза), если резистентность наиболее распространенных штаммов НР к метронидазолу не превышает 40%. В нашем регионе частота антибиотикорезистентности штаммов НР к метронидазолу колеблется от 40% до 55,5%, поэтому использование тройных эрадикационных протоколов, включающих этот препарат, недостаточно эффективно.
В последнее время для повышения эффективности эрадикационной терапии предложены схемы, включающие висмут трикалия дицитрат. Квадротерапия с использованием висмутсодержащих препаратов является возможной альтернативой в качестве протокола «первого выбора». Последнее положение является новым с точки зрения нормативной констатации, хотя и использовалось в практике ранее.
Согласно рекомендациям “Маастрихта-З”, эрадикация НР у детей должна проводиться теми же препаратами, что и у взрослых, с расчетом суточных доз лекарств, исходя из массы тела. Проведенные в нашей стране исследования у взрослых показали, что протоколом выбора эрадикационной терапии является 7-дневная тройная (ИПП-кларитромицин-амоксициллин). Высокая частота хеликобактерной инфекции в детской популяции обуславливает необходимость выбора эрадикационных схем и длительности лечения, оптимальных именно для детского возраста.
Целью настоящего исследования явилось определение эффективности протокола первой линии при лечении инфекции Helicobacter pylori у детей (PeptiPac) (омепразол-кларитромицин-амоксициллин) и оценка эффективности данной схемы, дополненной висмута трикалия дицитратом.
Пациенты и методы исследования
Под нашим наблюдением находилось 38 пациентов (22 мальчика и 16 девочек) в возрасте от 10 до 17 лет с диагнозом хронический гастрит, ассоциированный с инфекцией Helicobacter pylori. Диагноз устанавливался на основании анамнеза, характерных жалоб, данных объективного осмотра, лабораторного, эндоскопического и морфологического исследований. Критерии включения в исследование: наличие данных морфологического исследования гастробиоптатов; пациент не получал антисекреторных, антибактериальных и антацидных препаратов; добровольное информированное согласие родителей на участие их ребенка в исследовании. Критерии исключения из исследования: язва двенадцатиперстной кишки, непереносимость антибиотиков пенициллинового ряда или макролидов.
Все пациенты получали лечение в УЗ «17 детская городская клиническая поликлиника». Эзофагогастродуоденоскопия (ЭГДС) с прицельной биопсией слизистой оболочки (СО) тела и антрального отдела желудка проводилась на базе 2-й ДКБ, 4-й ДКБ и ДИКБ у всех больных до начала эрадикационной терапии. Контрольная ЭГДС с биопсией выполнялась через 4-8 недель после окончания лечения (но не ранее 2-х недель после отмены ИПП). Н. pylori выявляли бактериоскопическим методом в гастробиоптатах, а при проведении контроля – также и быстрым уреазным методом. Успех эрадикации констатировался при отсутствии НР в биоптатах и отрицательном результате быстрого уреазного теста.
При оценке эффективности лечения вычисляли показатель процентного соотношения вылечившихся от НР-инфекции пациентов в каждой группе. Четыре ребенка, получивших эрадикационную терапию, выбыли из дальнейшего исследования ввиду отказа от повторной эндоскопии из-за отсутствия жалоб (3 человека из I-й группы и 1 из II-й).
Больные были распределены на две группы. Дети с верифицированной НР–инфекцией получали одну из двух схем антихеликобактерной терапии (табл.1).
Таблица 1. Протоколы эрадикационной терапии первой линии
| № группы | Кол-во больных | Протокол эрадикации | Длительность терапии (дней) |
| I | 22 | омепразол, амоксициллин, кларитромицин (ОАК-7) | 7 |
| II | 16 | висмута трикалия дицитрат, омепразол, амоксициллин, кларитромицин (ВОАК-7) | 7 |
Результаты исследования и их обсуждение
Наследственная отягощенность по язвенной болезни и раку желудка выявлена у 10 детей (26,3%). Продолжительность симптомов желудочной диспепсии до момента включения в исследование составила от 6 мес. до 3-х лет. При осмотре больные наиболее часто жаловались на боль в эпигастральной области, возникающую как до, так и после приема пищи, раннее насыщение, снижение аппетита, тошноту, отрыжку, вздутие живота, неустойчивый стул. В клинической картине преобладал смешанный вариант функциональной диспепсии (у 20 детей), реже отмечались дискинетический (15 пациентов) и язвенноподобный (3 человека) варианты. Болезненность при пальпации в эпигастрии и пилородуоденальной зоне отмечалась практически у всех детей.
При ЭГДС у 37 пациентов были выявлены воспалительные изменения СО желудка и двенадцатиперстной кишки (отек, гиперемия, гиперсекреция) разной степени выраженности, у 1 ребенка эндоскопических изменений не обнаружено. Дефекты слизистой оболочки в виде единичных или множественных эрозий отмечались в восьми случаях. Сопутствующие нарушения моторики верхних отделов пищеварительного тракта: гастро-эзофагеальная рефлюксная болезнь с эзофагитом I-II степени выявлена у 8 детей (21%), из них в 2-х случаях отмечался дуодено-гастральный рефлюкс.
При гистологическом исследовании биоптатов слизистой оболочки желудка у 26 обследованных (68,4%) был выявлен пангастрит. Изолированное поражение антрального отдела наблюдалось в 29% случаев (11 пациентов), тела желудка – у 1 больного. По данным бактериоскопии, обсемененность НР слизистой оболочки антрума I степени выявлена у 7 пациентов (18,4%), II степени – у 14 (36,8%) и III степени — у 17 детей (44,8%). По данным бактериоскопии и результатам быстрого уреазного теста в I группе наблюдаемых эрадикация была достигнута у 16 (84,4%), а во II-й группе – у 14 (93,3%) пациентов (табл.2).
Таблица 2. Результаты эрадикационной терапии
| № группы | Количество больных | Эффективность эрадикации абс. ( % ) | |
| НР (-) | НР (+) | ||
| I | 19 | 16 (84,4%) | 3 (15,6%) |
| II | 15 | 14 (93,3%) | 1 (6,7%) |
Выраженных побочных эффектов, приведших к прекращению лечения, у наблюдаемых нами детей не отмечалось. Случаев кожной сыпи или других аллергических проявлений на прием препаратов не выявлено. Два пациента сообщили об увеличении частоты стула до 4 раз в сутки в течение 2-х дней, трое указывали на тошноту и двое на появление металлического привкуса во рту. Число побочных эффектов было одинаковым в обеих группах.
Гистологические исследования биоптатов после проведения эрадикационной терапии показали, что уже через месяц у большинства больных исчезли нейтрофильная и мононуклеарная инфильтрации эпителия и собственной пластинки слизистой оболочки, а также значительно снизились активность и интенсивность воспаления слизистой оболочки желудка (табл.3).
Таблица 3. Гистологические показатели активности и выраженности воспаления в слизистой оболочке желудка до и после эрадикации
| Гистологические показатели | Слизистая оболочка желудка | |||
| фундальный отдел до лечения (n=38) / после лечения (n=34) | антральный отдел до лечения (n=38) / после лечения (n=34) | |||
| абс. | % | абс. | % | |
| Активность воспаления | ||||
| — | 11/19 | 28,9/55,9 | 8/16 | 21,1/47,1 |
| + | 16/12 | 42,1/35,3 | 11/13 | 28,9/38 |
| ++ | 9/3 | 23,7/8,8 | 16/4 | 42/11,7 |
| +++ | 2/- | 5,3/- | 3/1 | 8/3,2 |
| Интенсивность воспаления | ||||
| — | 15/22 | 39,5/64,7 | 1/19 | 2,6/55,9 |
| + | 12/10 | 31,6/29.4 | 4/12 | 10,5/35,3 |
| ++ | 7/2 | 18,4/5,9 | 23/3 | 60,5/8,8 |
| +++ | 4/- | 10,5/- | 10/- | 26,4/- |
Выводы
1. Семидневная тройная терапия первой линии (Пептипак) у детей с хроническими НР-ассоциированными кислотозависимыми заболеваниями обеспечивает высокий процент (84,4%) эрадикации и улучшает клинические, эндоскопические и морфологические показатели.
2. При некотором удорожании лечения эффективность эрадикации повышается (р< 0,01) при включении в схему висмут трикалия дицитрата.
3. Пептипак хорошо переносится, клинически значимых побочных реакций в исследуемых группах детей не отмечено.
Литература:
1. Аруин Л.И. Качество заживления гастродуоденальных язв: функциональная морфология, роль методов патогенетической терапии // Экспериментальная и клиническая гастроэнтерология. Репринт. 2006. 5с. 2. Бовбель И.Э. Сравнительный анализ клинико-морфологических изменений и показателей липидного обмена, уровня среднемолекулярных пептидов у детей с хроническим гастродуоденитом. Автореф. дисс., канд. мед. наук. Минск,1999.– 22с. 3. Болезни пищевода и желудка. Ивашкин В.Т., Шептулин А.А. Кратк. практическое руководство. – М.: МЕДпресс-информ, 2002. – 144с. 4. Исаков В.А. Терапия кислотозависимых заболеваний ингибиторами протонного насоса в вопросах и ответах // Гастроэнтерология / хирургия. Репринт.2006, 7с. 5. Лапина Т.Л. Макролидный антибиотик кларитромицин в эрадикационной терапии инфекции Helicobacter pylori // РМЖ. Приложение. Болезни органов пищеварения. Том 8, №1, 2006. С.39-42. 6. Логинов А.Ф. «Маастрихт-3» – современная тактика диагностики и лечения инфекции Helicobacter pylori // Фарматека. №12 (127) 2006. — С.46-48. 7. Маев И.В., Самсонов А.А. Современные стандарты лечения кислотозависимых заболеваний, ассоциированных с H. pylori (материалы консенсуса Маастрихт-3) // Гастроэнтерология. Приложение к журналу Consilicum medicum №1, 2006.С.3- 8 8. Пиманов С.И., Макаренко Е.В. Анализ эффективности протоколов эрадикации инфекции Helicobacter pylori // Рецепт. – 2005. — № 1. – С. 19-23. 9. Пиманов С.И., Макаренко Е.В., Королева Ю.И. Возможности проведения эмпирической эрадикационной терапии у больных дуоденальной язвой в Республике Беларусь // Рецепт. – 2006. — № 1 (45). – С. 56-60. 10. Хавкин А.И., Жихарева Н.С. Современные принципы антихеликобактерной терапии у детей// Русский Медицинский Журнал. Том 13, №3, 2005. С.137-139.
И.Э.Бовбель, В.Ю. Малюгин
«Медицинская панорама» 2008, №3 ст. 57-58
Что происходит в организме?
На начальном этапе после попадания в желудок H. pylori, быстро двигаясь при помощи жгутиков, преодолевает защитный слой слизи и колонизирует слизистую оболочку желудка. Закрепившись на поверхности слизистой, бактерия начинает вырабатывать уреазу, благодаря чему в слизистой оболочке и слое защитной слизи поблизости от растущей колонии растёт концентрация аммиака и повышается pH. По механизму отрицательной обратной связи это вызывает повышение секреции гастрина клетками слизистой желудка и компенсаторное повышение секреции соляной кислоты и пепсина, с одновременным снижением секреции бикарбонатов.
Муциназа, протеаза и липаза, вырабатываемые бактерией, вызывают деполимеризацию и растворение защитной слизи желудка, в результате чего соляная кислота и пепсин получают непосредственный доступ к оголённой слизистой желудка и начинают её разъедать, вызывая химический ожог, воспаление и изъязвление слизистой оболочки.
Эндотоксин VacA, вырабатываемый бактерией, вызывают вакуолизацию и гибель клеток эпителия желудка. Продукты гена cagA вызывают дегенерацию клеток эпителия желудка, вызывая изменения фенотипа клеток (клетки становятся удлинёнными, приобретая так называемый «колибри фенотип»). Привлечённые воспалением (в частности, секрецией интерлейкина-8 клетками слизистой желудка) лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой, бактерия также вызывает окислительный стресс и запускает механизм программируемой клеточной смерти клеток эпителия желудка.
Антибактериальные препараты в схемах лечения хеликобактериоза у детей
Проводимые во многих странах мира исследования подтвердили соответствие свойств H. pylori постулатам Коха, определяющим инфекционного агента того или иного заболевания. Более того, в настоящее время доказана прямая зависимость воздействия H. pylori на слизистую оболочку желудка и возникновение злокачественных новообразований желудка. На протяжении истории изучения инфекции H. pylori учеными и исследователями многих стран отрабатывались различные подходы к терапии воспалительных заболеваний верхних отделов пищеварительного тракта, ассоциированных с этим микроорганизмом. Изучалась эффективность использования как монокомпонентной схемы лечения антибиотиками, так и комбинации препаратов разных групп. В результате этих исследований было показано, что одни антибактериальные препараты не способны оказывать свое воздействие в условиях обитания H. pylori (в кислой среде желудка), для эффективного применения других больным было необходимо принимать очень большие дозы препарата, а при применении третьих быстро развивалась резистентность микроорганизма к используемым лекарственным средствам. Тем не менее к настоящему времени разработаны такие схемы лечения, которые способны эффективно бороться с H. pylori, добиваясь его полной эрадикации (уничтожения) в короткие сроки, и достигать длительной ремиссии заболевания. Для эффективного лечения гастроэнтерологических заболеваний, ассоциированных с хеликобактерной инфекцией, необходимо применение специфических антибактериальных препаратов. Учитывая ту экологическую нишу, которую занимают эти микроорганизмы, проводимая антибактериальная терапия должна отвечать некоторым требованиям, а именно: 1. Используемые препараты должны эффективно воздействовать на Н. pylori; 2. Антибиотики должны быть устойчивыми к действию агрессивной кислой среды желудка; 3. Они должны обладать способностью проникать под слой желудочной слизи; 4. Иметь локальное действие в области слизистой оболочки; 5. Быстро выводиться из организма, не накапливаясь в других тканях и органах. Хеликобактерии, являясь микроаэрофилами, способны нормально функционировать только в привычной среде обитания – на поверхности слизистой оболочки под слоем слизи. Вне организма они крайне чувствительны практически к любому агрессивному воздействию (алкоголь, атмосферный воздух, антибактериальные препараты, действующие на грамотрицательную флору). Однако желудочная слизь, изменения рН среды в просвете желудка и непосредственной близости от Н. pylori во многом меняют действие лекарственных препаратов. Эти условия значительно сужают круг препаратов, используемых для лечения хеликобактериоза. Проблема лечения хеликобактериоза у взрослых, по сведению некоторых авторов, решается назначением короткого курса (3–4 дня) комбинации антибиотиков в пределах максимально разрешенных доз [1,2,3,4,5], что, однако, неприемлемо в педиатрии. В то же время у детей с гастродуоденальной патологией, обусловленной наличием хеликобактерий, появляются изменения биоценоза желудочно–кишечного тракта. Так, рядом авторов был выявлен значительный дефицит лактобацилл и бифидофлоры с одновременным нарастанием уровня условно–патогенных микроорганизмов на фоне хронических гастродуоденальных заболеваний, выраженность нарушений нарастала при проведении антибактериальной терапии [3,6]. В конце 80–х годов, на заре «эпохи хеликобактериоза» считалось, что для эффективного лечения хронических воспалительных заболеваний восходящего отдела пищеварительного тракта достаточно назначения одного препарата (монотерапия) или двойной терапии. Для этих целей обычно использовался метронидазол в сочетании с коллоидным субцитратом висмута или полусинтетическими антибиотиками пенициллинового ряда в возрастных дозировках. Лечение проходило в среднем 14–28 дней и приводило к эрадикации у 70–80% детей. Однако длительный курс лечения, широкое и не всегда оправданное назначение антибиотиков при гастродуоденитах и язвенной болезни у детей и взрослых привело к тому, что уже к 1991 году использование одного или двух препаратов не вызывало эрадикацию. Для эффективного лечения хеликобактериоза в схему терапии были включены другие антибиотики. Следует отметить, что использование коллоидного субцитрата висмута замедляет процессы всасывания некоторых антибактериальных препаратов (тетрациклин, кларитромицин, амоксициллин), способствуя тем самым повышению их концентрации в желудочном содержимом – месте приложения при лечении хеликобактериоза. В 1992–94 гг. наиболее эффективной являлась тройная схема лечения, включающая коллоидный субцитрат висмута 120 мг 3 раза в день, метронидазол 20 мг/кг/сутки в 3 приема, амоксициллин 30 мг/кг 3 раза в день. Однако уже с середины 1994 года степень эрадикации от проводимой терапии снизилась и составляла всего 46,4%, а реинфицирование у вылеченных ранее детей наступало через 1–4 месяца [3,5,8]. Учитывая увеличение количества резистентных к метронидазолу штаммов, активно проводились исследования с использованием новых эффективных антибактериальных препаратов, позволяющих добиться хороших результатов при эрадикационной терапии H. pylori. В итоге этих исследований был сформулирован ряд положений, представленных на заседании рабочей группы по изучению Helicobacter pylori Европейского общества педиатров, гепатологов и диетологов (H. pylori Working Group of the European Society for Pediatric Gastroenterology, Hepatology and Nutrition (ESPGHN) в октябре 2000 г. В частности, в этих рекомендациях отдается предпочтение использованию эрадикационных трехкомпонентных схем, сочетающих ингибиторы протонной помпы и два антибиотика, одним из которых является кларитромицин. В соответствии с этими рекомендациями на IX съезде педиатров России «Детское здравоохранение России: стратегия развития» (февраль 2000 года, Москва) были приняты и утверждены схемы лечения хеликобактериоза у детей. К препаратам, рекомендованным для использования у детей с 5–летнего возраста в эрадикационной терапии, относятся следующие: Различные комбинации этих препаратов позволили составить следующие схемы лечения хеликобактериоза: I Однонедельная тройная терапия с препаратом висмута: 1. – Субцитрат висмута; – Амоксициллин или кларитромицин; – Нифуратель/фуразолидон. 2. – Субцитрат висмута; – Кларитромицин; – Амоксициллин. II Однонедельная тройная терапия с блокаторами Н+, К+–АТФ–азы: 1. – Омепразол; – Кларитромицин; – Нифуратель/фуразолидон. 2. – Омепразол; – Кларитромицин; – Амоксициллин. III Однонедельная квадротерапия: – Субцитрат висмута; – Амоксициллин или кларитромицин; – Нифуратель/фуразолидон; – Омепразол/ранитидин. Квадротерапия рекомендуется для лечения штаммов, резистентных к антибиотикам, при неудачном предыдущем лечении или в том случае, когда определение чувствительности штамма микроорганизма не представляется возможным. Основным препаратом для лечения инфекции H. pylori у детей является коллоидный субцитрат висмута, с которым сочетаются антибиотики – амоксициллин или различные макролиды. К сожалению, популярные еще совсем недавно схемы, сочетающие субцитрат висмута, антибиотик и метронидазол, за последние годы начали утрачивать свою эффективность. Это происходит из–за появления штаммов, резистентных к лекарственным препаратам. H. pylori не развивают резистентности к препаратам висмута, практически нет резистентности к амоксициллину (описаны всего несколько штаммов, в том числе 2 – в России, не чувствительных к этому антибиотику). В то же время постоянно увеличивается число штаммов, резистентных к метронидазолу и кларитромицину (а также, учитывая перекрестную резистентность H. pylori, и к другим макролидам). В настоящее время количество резистентных штаммов у детей к метронидазолу превышает 42%, а к кларитромицину – 12%. Появились штаммы с комбинированной резистентностью к метронидазолу и антибиотикам. Именно поэтому в последнее время уделяется большое внимание разработке новых альтернативных схем лечения хеликобактериоза. Метронидазол из существующих схем исключается, а вместо него все более широко применяется Макмирор и фуразолидон. Эти препараты впервые стали использоваться в гинекологии для лечения штаммов хламидий, резистентных к метронидазолу. Достаточно много работ было посвящено исследованию эффективности фуразолидона на H. pylori в составе эрадикационных схем. Фуразолидон является эффективным средством, к которому практически не вырабатывается резистентность у H. pylori. Однако применение этого препарата имеет ряд ограничений. В частности, в ряде стран (Япония, Корея, Ливан, Италия) применение фуразолидона было запрещено или сильно ограничено из–за возможных мутагенных свойств, которые обнаруживались при исследованиях на животных. Однако ВОЗ разрешает использовать этот препарат короткими курсами. Другими существенными недостатками фуразолидона являются неудовлетворительные органолептические свойства (при приеме этого препарата многие дети жалуются на горечь во рту, тошноту). Кроме того, для достижения оптимальной концентрации препарата в организме его нужно принимать четыре раза в день, в отличие от других компонентов эрадикационной терапии. Эти качества фуразолидона значительно снижают комплаентность всей схемы лечения и тем самым – эффективность проводимой эрадикации. Другим препаратом из группы нитрофурановых является Макмирор (нифуратель). Этот препарат по своему действию напоминает фуразолидон, но в отличие от последнего он безопасен даже при длительном применении. Кроме того, он обладает хорошими органолептическими свойствами и при приеме не вызывает неприятных ощущений, горечи или тошноты. Период полувыведения препарата достаточно велик, что позволяет применять Макмирор 2 раза в день, как и остальные компоненты антихеликобактерной терапии. Проведено уже достаточно большое количество исследований по применению эрадикационных схем с Макмирором в качестве второго антибиотика [9,10,11]. В настоящее время Макмирор включен в рекомендации Союза педиатров России по диагностике и лечению заболеваний, ассоциированных с хеликобактериозом у детей. Как показали результаты собственных исследований, эффективность схем лечения с применением Макмирора в сочетании с субцитратом висмута и амоксициллином составляет более 84%. Амоксициллин является высокоэффективным лекарственным препаратом, по отношению к H. pylori к нему практически не развивается резистентность. Однако применение этого антибиотика ограничено, с одной стороны, выраженным воздействием на микрофлору кишечника. С другой стороны, применение антибиотиков пенициллинового ряда ограничивается высокой частотой развития аллергических реакций. Именно поэтому антибиотиками выбора при лечении H. pylori инфекции остаются макролиды. В группе макролидов для лечения заболеваний, ассоциированных с H. pylori, как препарат первого эшелона рекомендован кларитромицин. Этот препарат устойчив к действию соляной кислоты желудка, быстро всасывается в желудочно–кишечном тракте независимо от приема пищи. Биодоступность кларитромицина у детей при назначении в дозе 7,5 мг/кг составляет 52–55%. Пиковая концентрация в плазме крови и ПФК (площадь под фармакокинетической кривой) возрастают при приеме препарата во время еды на 28 и 42% соответственно [12]. Наибольший эффект от применения макролидов показали схемы, сочетающие ингибиторы протонной помпы и макролиды. Эффективность применения кларитромицина в эрадикационных схемах при хеликобактериозе обусловлена благоприятным фармакокинетическим взаимодействием при сочетании кларитромицина с ингибиторами протонной помпы. Кларитромицин ингибирует метаболизм омепразола, а омепразол, в свою очередь, ингибирует метаболизм кларитромицина, следствием чего является увеличение концентраций обоих препаратов в плазме крови и возникновение кумуляционного эффекта при их применении [13]. Ограничением применения антибиотиков в схемах лечения заболеваний, ассоциированных с H. pylori является развитие резистентности этих микроорганизмов к применяемым препаратам. К настоящему времени чувствительность H. pylori к кларитромицину в ряде стран Западной Европы составляет 83–89%, но этот показатель снижается. Это обусловлено, с одной стороны, необоснованным назначением макролидов при лечении различных инфекционных заболеваний, с другой – развитием точечных мутаций 23S рибосомальной РНК у H. pylori при проведении предыдущих эрадикационных мероприятий, не приведших к полному уничтожению микроорганизма. Однако несмотря на увеличивающееся количество штаммов, резистентных к кларитромицину, эрадикационные схемы на основе этого антибиотика в сочетании с омепразолом остаются и по сей день ведущими в различных исследованиях и позволяют достигать эрадикации у 82–88% больных [14]. Таким образом, эффективность проведения эрадикационной терапии заболеваний, ассоциированных с инфекцией H. pylori, во многом зависит от грамотно проведенной антибиотикотерапии в схемах эрадикации, учитывающей как фармакокинетическое действие препаратов, так и социально–экономические аспекты проводимого лечения.

Литература 1. Atherton JC; Hudson N; Kirk GE; et al.Amoxycillin capsules with omeprazole for the eradication of Helicobacter pylori. Assessment of the importance of antibiotic dose timing in relation to meals.//AU: // Aliment Pharmacol Ther.– 1994.– Oct. 8(5).– P. 495–8.. 2. Sobhani I; Chastang C; De Korwin JD; et al.Antibiotic versus maintenance therapy in the prevention of duodenal ulcer recurrence. Results of a multicentric double–blind randomized trial./ // Gastroenterol Clin Biol.– 1995.– Mar. –19(3).– P. 252–8. 3. Sieber CC; Frei R; Beglinger C; et al. Helicobacter pylori resistance against metronidazole in Switzerland: implications for eradication therapy? / // Schweiz Med Wochenschr.– 1994.– Aug 9. 124(31–32).–P.1381–4. 4. Marshall B.J., Warren J.R. Unindencifield curved bacilli in the stomach of patient with gastritis and peptic ulceration. // Lancet.– 1984.– v.1.– p.1311. 5. O’Connor HJ. Eradication of Helicobacter pylori.// AADE Ed J.– 1994.– Dec. 6 Suppl 1P.– S113–9. 6. Лыкова Е.А., Сидоренко С.В., Бондаренко В.М. и др.Антибактериальная терапия и коррекция микроэкологических нарушений при хеликобактериозе у детей. / // Диагностика и лечение.– 1996.– № 12.– С.75– 77 7. Zala G; Wirth HP; Bauer S; et al. Eradication of metronidazole–resistant Helicobacter pylori: is omeprazole/amoxicillin a therapeutic alternative? Schweiz Med Wochenschr.– 1994.– Aug 9. 124(31–32).– P. 1385–90. 8. Хроническй гастрит / Аруин Л.И., Григорьев П.Я., Исаков В.А., Яковенко Э.П. // Амстердам.– 1993.– 362 с. 9. Лазутина Т. А., Христ А. А.Эффективность эрадикационной терапии при язвенной болезни двенадцатиперстной кишки // Российский журн. гастроэнт и гепат. 2003, № 3, приложение 19, с. 28 10. Малямова Л.Н., Глазырина Н.В., Юрченко Е.Ю./Сравнительная эффективность схем антихеликобактерной терапии у детей с заболеваниями гастродуоденальной области.// Российский журн. гастроэнт и гепат. 2003, № 3, приложение 19, с. 48 11. Щербаков П.Л., Вартапетова Е.Е., Салмова В.С. и соавт./Сравнительная оценка эффективности и безопасности препаратов висмута у детей.// Российский журн. гастроэнт и гепат. 2003, № 3, приложение 19, с. 56–59 12. Gan V.N., Chu S.Y. et al. Pharmacokinetics of a clarithromycin suspension in infant and children. Antimicrob. Agents Chemother., 1992, 36^ 2478–2480. 13. Mainz D., Borner K., Koeppe P. et al. Parmacokinetics of lansoprazole, amoxicillin and clarithromycin after simultaneous and single administration. In: The 37th Interscience Conference on Antimicrobial Agents and Chemotherapy. Toronto, 1997: abstr. A.–120A. 14. Huang J.–Q., Hunt R.H. The importance of clarithromycin dose in the management of Helicobacter pylori infection: a meta–analysis of triple therapies with a proton pump inhibitor, clarithromycin and amoxycillin or metronidazole. Aliment. Pharmacol. Ther. 1999: 13: 719–729.
Заблуждения, связанные с Helicobacter pylori
Нередко, при обнаружении Helicobacter pylori, пациенты начинают беспокоиться об их эрадикации (уничтожении). Само наличие Helicobacter pylori в желудочно-кишечном тракте не является причиной для немедленной терапии с применением антибиотиков или других средств. В России количество носителей Helicobacter pylori достигает 70 % населения и подавляющее большинство из них не страдает какими-либо заболеваниями желудочно-кишечного тракта. Процедура эрадикации предполагает прием двух антибиотиков (например, кларитромицина и амоксициллина).
У пациентов, имеющих повышенную чувствительность к антибиотикам, возможны аллергические реакции — от антибиотик-ассоциированной диареи (не тяжелое заболевание) до псевдомембранозного колита, вероятность возникновения которого мала, но процент летальных исходов большой. Кроме того, прием антибиотиков отрицательно воздействует на «дружественную» микрофлору кишечника, мочеполовых путей и способствует развитию резистентности к данному виду антибиотиков. Имеются данные, что после успешной эрадикации Helicobacter pylori в течение ближайших лет чаще всего наблюдается реинфекция слизистой желудка, которая уже через 3 года составляет 32±11 %, через 5 лет — 82–87%, а через 7 лет — 90,9% (Циммерман Я.С.).
Пока боль не проявилась, хеликобактериоз лечить не следует. Более того, у детей до восьмилетнего возраста вообще не рекомендуется проводить эрацикационную терапию, потому что у них иммунитет еще не сформирован, антитела к Helicobacter pylori не вырабатываются. Если у них провести эрадикацию до 8-летнего возраста, то через день, пообщавшись кратковременно с другими детьми, «схватят» эти бактерии (П.Л. Щербаков).
Helicobacter pylori однозначно требует эрадикации, если у больного имеется язва желудка или двенадцатиперстной кишки, МАLТома или если у него была резекция желудка по поводу рака. Многие авторитетные гастроэнтерологи (не все) в этот список включают также атрофический гастрит. Эрадикация Helicobacter pylori может быть рекомендована для снижения риска развития рака желудка. Известно, что как минимум 90% случаев рака желука связаны с H. pylori-инфекцией (Старостин Б.Д.).
Язвенная болезнь в мире больших цифр
По различным данным, от 10 до 15 % населения земного шара в какой‑то период своей жизни сталкивается с этим заболеванием. И в России, и во всем мире язвенная болезнь считается наиболее распространенной желудочно-кишечной патологией, причем с возрастом вероятность заболеть становится выше. Во многом это связано с тем, что риск «подхватить» виновника всех бед — маленькую, но очень устойчивую в кислой среде Helicobacter pylori — с годами только растет. И если в 20 лет вероятность инфицирования составляет 20 %, то с каждым последующим десятилетием она увеличивается ровно на 10 %. Выходит, что к началу шестого десятка половина жителей планеты уже близко знакомы с H. pylori.
С каждым годом диагностируется все больше новых случаев заболевания. Медики связывают такую неутешительную тенденцию с широким использованием нестероидных противовоспалительных препаратов, значительно повышающих уязвимость стенки желудка. Однако достижения современной медицины позволяют давать очень благоприятный прогноз при язвенной болезни. А ведь еще в конце прошлого века все было не так однозначно.
Таблица 1.
Схемы эрадикационной терапии
| Препарат | Доза | Кратность применения |
| Эрадикационная терапия 1 линии (7–10 дней) | ||
| ИПП | стандартная доза | 2 раза в день |
| кларитромицин | 500 мг | |
| амоксициллин | 1г | |
| Терапия 2 линии (10–14 дней) — при неэффективности или непереносимости терапии первой линии | ||
| ИПП | стандартная доза | 2 раза в день |
| метронидазол или амоксициллин | 500 мг (амоксициллин — 1 г) | 3 раза в день (амоксициллин 2 раза в день) |
| тетрациклин | 500 мг | 4 раза в день |
| висмута препарат | 120 мг | |
Симптомы и первые признаки
Развитие инфекции в пищеварительном тракте длительное время протекает практически бессимптомно. Бактерии прикрепляются к слизистой кишечника и 12-перстной кишки, вырабатывают токсичный фермент, который постепенно разъедает клетки эпителиальных тканей.
Только когда на стенках органа появляются эрозии и язвочки, пациента начинают тревожить неприятные симптомы Helicobacter pylori:
- чувство вздутия и переполненности желудка после приёма пищи;
- частая отрыжка с привкусом кислоты во рту;
- регулярно болит желудок;
- наблюдается жжение в пищеводе, горьковатый вкус во рту;
- регулярные приступы тошноты, рвотные позывы;
- повышенное газообразование, которое провоцирует колики и дискомфорт.
У взрослых неприятные признаки бактерии хеликобактер пилори появляются чаще всего после еды и не проходят даже после опорожнения кишечника. Пациента одолевает вялость, упадок сил, сонливость, раздражённость. Наличие helicobacter pylori в желудке или двенадцатиперстной кишке может сопровождаться мелкой кожной сыпью, в частности, на лице. При гастрите или язве, вызванными хеликобактериозом, пациент жалуется на изменения в стуле (запор или понос), неприятный запах изо рта, ломкость ногтевой пластины и постоянное общее недомогание.
Маастрихтские рекомендации и общие требования к терапии
Открытие того, что ведущим этиологическим и патогенетическим фактором развития воспалительных заболеваний оболочек желудка и 12-перстной кишки является возбудитель Helicobacter pylori, положило начало разработке принципиально новых терапевтических схем. Основой их стало применение антибиотиков, обладающих возможностью непосредственного уничтожения бактерии. Изучение особенностей строения микроорганизма, понимание, что такое Хеликобактер, и как она оказывает негативное действие на слизистую, позволило создать эффективные схемы лечения, которые успешно применяют сегодня во всем мире.
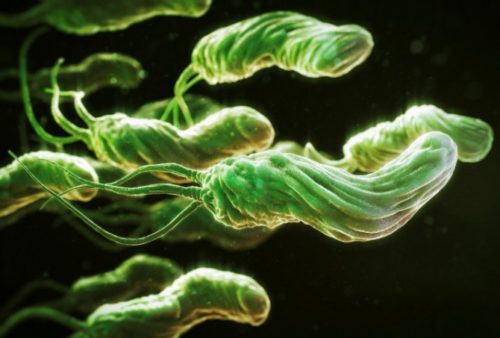
Хеликобактер пилори – спиралевидная грамотрицательная бактерия
Для выявления Хеликобактер используется дыхательный уреазный тест, не требующий много времени, безвредный, не вызывающий никаких неприятных ощущений и представляющий собой золотой стандарт диагностики инфекции. Симптомы и лечение хеликобактерного заражения индивидуальны. Факт присутствия возбудителя в организме далеко не всегда сопровождается нарушениями и требует приема лекарственных препаратов.
Для выяснения и согласования лучших подходов к выявлению и лечению Хеликобактер в Европе была сформирована группа из ведущих специалистов гастроэнтерологов. Периодически на основании проводимых конференций и совещаний они публикуют протоколы – Маастрихтские консенсусы, по названию города, где проходили первые встречи.
Всего их на данный момент существует пять:
- Маастрихт 1 (1996 г., Маастрихт);
- Маастрихт 2 (2000 г., Маастрихт);
- Маастрихт 3 (2005 г., Флоренция);
- Маастрихт 4 (2012 г., Флоренция);
- Маастрихт 5 (2016 г., Флоренция).
По результатам консенсуса «Маастрихт 2» было установлено, что, к сожалению, ни одна из проводимых схем эрадикации, несмотря на одновременное применение нескольких препаратов, не гарантирует полное уничтожение инфекции. В связи с этим было рекомендовано лечить пациентов сначала по схеме первой линии, а затем при отсутствии терапевтического эффекта – по схеме второй линии.
Необходимость проведения повторных курсов антихеликобактерной терапии объясняется повышением резистентности H. pylori к назначаемым антибиотикам, что является главной проблемой современной гастроэнтерологии при лечении ассоциированных с возбудителем заболеваний.
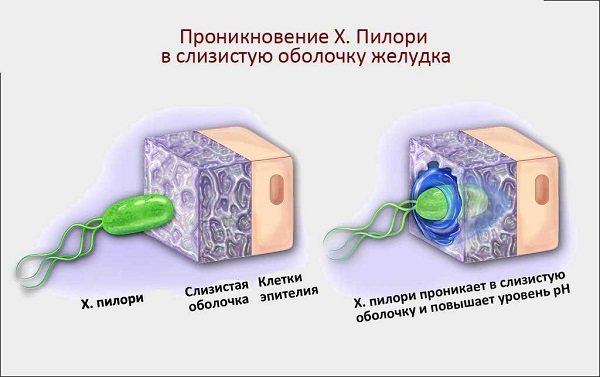
Проникновение возбудителя в слизистую оболочку желудка
Применяемые сегодня, чтобы вылечить хеликобактерную инфекцию, эрадикационные схемы были утверждены на «Маастрихт 4».
Основные требования для них:
- получение минимум 80% случаев избавления от инфекции, заживления гастрита или язвы, подтвержденного повторным исследованием;
- длительность терапии не более 14 суток;
- приемлемая низкая токсичность используемых препаратов;
- безопасность, наличие побочных эффектов менее чем у 15% пациентов;
- отсутствие серьезных реакций, требующих досрочной отмены таблеток;
- доступность и удобство для пациентов, небольшое количество приемов лекарства в сутки;
- преодоление постоянно растущей устойчивости бактерии к применяемым антибиотикам;
- возможности замены препаратов внутри схемы при выявлении аллергических реакций или других проблем.
Интересно! Исторически первой успешно апробированной схемой эрадикации Хеликобактер было применение субсалицилата висмута и Метронидазола. Испытал ее на себе ученый Барри Маршалл, обнаруживший совместно с коллегой Helicobacter pylori в слизистой желудка. В 1984 г. он преднамеренно выпил содержимое чашки Петри с культурой бактерий, а затем вскоре после появления характерных симптомов спровоцированного гастрита провел указанное лечение. После 14 дней терапии по результатам биопсии возбудителя в желудке обнаружено не было.
Какие заболевания может спровоцировать H. pylori
Наличие H. pylori в желудке само по себе не является заболеванием. Однако эти бактерии повышают риск развития различных болезней пищеварительного тракта.
Хотя колонизация слизистой желудка хеликобактери вызывает гистологический гастрит у всех зараженных людей, лишь у небольшой части из них развивается клиническая картина этого заболевания. По оценкам ученых, у 10-20% людей, зараженных хеликобактер пилори, развивается язва, а у 1-2% — рак желудка.
Заболевания, развитие которых связано с хеликобактерной инфекцией:
- Гастрит – это воспаление слизистой оболочки желудка. Вскоре после инфицирования H. pylori у человека развивается острый гастрит, связанный иногда с диспепсией или тошнотой. Острый воспалительный процесс поражает весь желудок и приводит к снижению секреции кислоты. Через определенный период времени после острого гастрита развивается хронический.
- Язва желудка и двенадцатиперстной кишки. Согласно научным данным, 70-85% всех язв желудка и 90-95% всех язв двенадцатиперстной кишки вызваны бактерией
- Функциональная диспепсия – это боль в верхней части живота, не вызванная язвой или другими поражениями желудка. Результаты научных исследований показали, что некоторые виды диспепсии связаны с инфекцией. Лечение, направленное на эрадикацию бактерий, облегчает состояние у многих пациентов с функциональной диспепсией, а также снижает риск развития язв и рака желудка в будущем.
- Рак желудка. Хеликобактер пилори – признанный учеными этиологический фактор развития рака желудка. По одной из гипотез, бактерии способствуют выработке свободных радикалов и увеличивают риск возникновения мутаций в клетках желудка.
- MALT-лимфома желудка. О связи инфекции с этим заболеванием впервые сообщили в 1991 году. Считается, что эта бактерия вызывает 92-98% MALT-лимфом желудка.
Борьба за признание
Только в 1994 году Национальные институты здравоохранения США документально подтвердили тесную связь между H. pylori и язвенной болезнью и рекомендовали лечить ее с помощью антибиотиков. Тем не менее в 1995 году большинство больных язвой желудка по‑прежнему получали антисекреторную терапию, и лишь 5 % счастливчиков встречали врачей, которые назначали антибиотики.
В том же 95‑м Американский фонд здравоохранения провел крупный опрос среди людей, страдающих язвенной болезнью. Результаты были впечатляющими. Спустя более чем 10 лет после открытия H. pylori 90 % пациентов не имели понятия о том, что истинной причиной их заболевания была инфекция, и винили во всем стрессы и слабые нервы.
В 1996 году Американское агентство по контролю за лекарственными препаратами (FDA) впервые в мире одобрило применение антибиотика для лечения язвенной болезни. Еще через год, в тех же Соединенных Штатах, запускается национальная кампания, цель которой — информировать врачей и фармацевтов о связи между язвенной болезнью желудка и H. pylori. Вскоре весть об абсолютной излечимости прежде довольно тяжелого заболевания разлетелась по странам, городам и весям, и началась новая эпоха в терапии язвенной болезни.
Таблица 3.
Комбинированные препараты для эрадикационной терапии
| Международное название | Торговое название |
| омепразол+амоксициллин+кларитромицин | Пилобакт АМ |
| лансопразол+амоксициллин+кларитромицин | Ланцид Кит, Хелитрикс |
А что же первооткрыватели? Они сполна ощутили сладкое бремя славы и в лучах ее согреваются и поныне. В 2005 году в Каролинском институте Стокгольма Маршалл и Робин Уильям получили самую престижную премию, которая присуждается вот уже больше 100 лет за выдающиеся заслуги в науке и культуре. Золотая медаль, сопровожденная дипломом Нобелевского комитета и очень солидным денежным вознаграждением, была присвоена австралийским ученым за «открытие бактерии Helicobacter pylori и ее роли в развитии гастрита и язвенной болезни». А эрадикационная терапия, начало которой было положено в далеком 82‑м, продолжает спасать миллионы больных, излечивая от язвы и предупреждая рак.
Препараты для эрадикации Helicobacter pylori
Сегодня разработано несколько схем эрадикационной терапии хеликобактер пилори, которые подбираются индивидуально. Традиционный антихеликобактерный комплекс включает:
антибиотик (амоксициллин, кларитромицин или тетрациклин); ингибитор протонной помпы; метронидазол; препараты висмута.
Амоксициллин
Антибиотик пенициллинового ряда, амоксициллин, и структурно, и по спектру активности очень близок к ампициллину. Амоксициллин стабилен в кислой среде. Препарат ингибирует синтез клеточной стенки бактерий, действует и местно, и системно после абсорбции в кровоток и последующего проникновения в просвет желудка. H. pylori демонстрирует хорошую чувствительность к амоксициллину in vitro, однако для эрадикации бактерии требуется комплексная терапия.
Кларитромицин
Кларитромицин, 14‑членный макролид, представляет собой производное эритромицина с аналогичным спектром активности и показаниями к применению. Однако в отличие от эритромицина он более устойчив к воздействию кислот и имеет более длительный период полувыведения. Результаты исследований, доказывающих, что схема тройной антихеликобактерной терапии с использованием кларитромицина дает положительный результат в 90 % случаев, привели к широкому использованию антибиотика. В связи с этим в последние годы было зафиксировано увеличение распространенности устойчивых к кларитромицину штаммов H. pylori.
Тетрациклины
Точкой приложения тетрациклинов является бактериальная рибосома. Антибиотик прерывает биосинтез белка и специфически связывается с 30S-субъединицей рибосомы, исключая добавление аминокислот к растущей пептидной цепи. Тетрациклин доказал in vitro эффективность против H. pylori и сохраняет активность при низком pH.
Ингибиторы протонной помпы (ИПП)
Терапия ИПП доказала свою эффективность в различных клинических исследованиях. Предполагается, что антисекреторные препараты группы ИПП могут способствовать повышению концентрации антимикробных средств, в частности, метронидазола и кларитромицина, в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается и концентрация, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильность антимикробных препаратов. Различные ИПП не отличаются по эффективности.
Метронидазол
H. pylori, как правило, очень чувствительны к метронидазолу, эффективность которого не зависит от pH среды. После перорального или инфузионного применения в желудочном соке достигаются высокие концентрации препарата, что позволяет достичь максимального терапевтического эффекта. Метронидазол приводит к потере спиральной структуры ДНК H. pylori, в результате чего происходит поломка в ДНК и бактерия погибает.
Препараты висмута
Висмут стал одним из первых препаратов для эрадикации H. pylori. Существуют доказательства, что висмут оказывает непосредственное бактерицидное действие, хотя его минимальная ингибирующая концентрация (МИК — наименьшее количество препарата, ингибирующее рост возбудителя) в отношении H. pylori слишком высока. Как и другие тяжелые металлы, такие как цинк и никель, соединения висмута снижают активность фермента уреазы, который принимает участие в жизненном цикле H. pylori. Кроме того, препараты висмута обладают местной антимикробной активностью, действуя непосредственно на клеточную стенку бактерий и нарушая ее целостность.
Диагностика
Для обнаружения инфекции в организме используются различные методы обследования, каждый из которых имеет свои преимущества, недостатки и ограничения. Традиционно все методы разделяют на неинвазивные и инвазивные.
Инвазивные методы обнаружения:
- Гистологическое исследование – изучение специально окрашенных образцов тканей желудка, полученных с помощью биопсии во время эндоскопического обследования, под микроскопом.
- Микробиологический посев и выделение культуры хеликобактери. Для получения материала для посева используют биопсию или образец желудочного сока, которые получают во время эндоскопического обследования.
- Полимеразная цепная реакция (ПЦР) – позволяет обнаружить инфекцию в небольших образцах тканей, полученных с помощью биопсии.
- Быстрый уреазный тест – во время этого метода используется способность бактерии к переработке мочевины. Образец тканей, полученный с помощью биопсии, помещают в среду, содержащую мочевину и индикатор рН. Бактерии расщепляют мочевину на двуокись углерода и аммиак, из-за чего повышается рН среды и изменяется цвет индикатора.
Неинвазивные методы обнаружения:
- Серологические анализы крови, с помощью которых можно обнаружить антитела к хеликобактери.
- Дыхательный тест с мочевиной. Во время этого обследования пациенту дают выпить раствор с мочевиной, молекула которой содержит меченый изотоп углерода. Хеликобактери расщепляет мочевину на аммиак и углекислый газ, который содержит меченый атом углерода. Этот газ проникает в кровоток и выводится через легкие с воздухом. Через полчаса после употребления раствора с мочевиной пациент выдыхает в специальный мешочек, в котором с помощью спектрометрии обнаруживают меченый атом углерода.
- Выявление антигенов H. pylori в кале.
Как избавиться от Helicobacter pylori?
В 2020 году приемлемой схемой эрадикации Helicobacter pylori у взрослых считается лечебный режим, обеспечивающий не менее чем 80 % эффективно подтверждённого повторным обследованием излечения от хеликобактерной инфекции и заживления язвы или гастрита, имеющий продолжительность не более 14 суток и обладающий приемлемо низкой токсичностью (побочные эффекты должны развиваться не более чем у 10—15 % больных и в большинстве случаев не быть столь серьёзными, чтобы требовать досрочного прекращения лечения).
Постоянно разрабатываются новые схемы и протоколы эрадикации хеликобактера. При этом преследуется несколько целей:
- повышение удобства лечения для больных и степени соблюдения ими лечебного режима:устранение необходимости в строгой «противоязвенной» диете
- благодаря применению мощных ингибиторов протонного насоса;
- уменьшение продолжительности лечения (с 14 до 10, затем 7 дней);
- сокращение числа одновременно принимаемых наименований лекарств за счёт применения комбинированных препаратов;
- сокращение количества приёмов в сутки за счёт применения пролонгированных форм препаратов или препаратов с большим периодом полувыведения (T1/2);
- уменьшение вероятности нежелательных побочных эффектов;
- преодоление растущей устойчивости хеликобактера к антибиотикам;
- удовлетворение потребности в альтернативных схемах лечения при наличии аллергии к каким-либо из компонентов стандартной схемы либо при неудаче первоначального режима лечения.
В 2020 году экспертами Маастрихтом-IV были рекомендованы следующие эрадикационные схемы Helicobacter pylori:
Схема лечения рекомендованная на конференции Маастрихтом-IV
Трёхкомпонентная терапия, была предложена на первой Маастрихтской конференции и стала универсальной схемой лечения инфекции H. pylori. Она рекомендована всеми мировыми согласительными конференциями.
Схема включает препараты:
- один из ингибиторов протонного насоса (ИПН) в «стандартной дозировке» (омепразол 20 мг, лансопразол 30 мг, пантопразол 40 мг, эзомепразол 20 мг, или рабепразол 20 мг 2 раза в день) не менее 7 дней
- кларитромицин (500 мг 2 раза в день) 7 дней
- амоксициллин (1000 мг 2 раза в день) или метронидазол (500 мг 2 раза в день) 7 дней.
При этом показано, что схемы ИПН + кларитромицин + метронидазол (тинидазол) и ИПН + кларитромицин + амоксициллин эквивалентны. Установлено, что эффективность тройной терапии повышается, при увеличении её продолжительности до 10 или 14 дней (в зависимости от степени обсеменённости Helicobacter pylori и переносимости терапии пациентом).
Схема лечения рекомендованная обществом гастроэнтерологов России
В связи с различной резистентностью к антибиотикам в разных регионах мира, распространённостью различных штаммов Нр, генетическими особенностями населения, в разных странах или группах стран вырабатываются свои рекомендации в отношении эрадикации Нр. Некоторые из этих параметров, в частности, резистентность Нр к определенным антибиотикам, меняется с течением времени. Выбор конкретной схемы определяется также индивидуальной непереносимостью больного к препаратам, а также чувствительностью штаммов Нр, которыми инфицирован больной.
На съезде Научного общества гастроэнтерологов России были приняты следующие схемы эрадикации Нр, они актуальны на 2019 год:
1) Первые вариант. Трёхкомпонентная терапия, включающая перечисленные ниже препараты, которые принимаются в течение 10-14 дней:
- один из ИПН в «стандартной дозировке» 2 раза в день +
- амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) +
- кларитромицин (500 мг 2 раза в день), или джозамицин (1000 мг 2 раза в день) или нифурател (400 мг 2 раза в день).
2) Второй вариант. Четырёхкомпонентная терапия, включающая в дополнении к препаратам варианта 1 препарат висмута, её продолжительность также 10—14 дней:
- один из ИПН в «стандартной дозировке» +
- амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) +
- кларитромицин (500 мг 2 раза в день), или джозамицин (1000 мг 2 раза в день), или нифурател (400 мг 2 раза в день) +
- висмута трикалия дицитрат 120 мг 4 раза в день или 240 мг 2 раза.
3) Третий вариант. Если у больного имеется подтверждённая внутрижелудочной рН-метрией атрофия слизистой оболочки желудка с ахлоргидрией и ему, таким образом, нецелесообразно назначать кислотоподавляющие препараты (ИПН или Н2-блокаторы), применяется третий вариант (продолжительностью 10—14 дней):
- амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) +
- кларитромицин (500 мг 2 раза в день), или джозамицин (1000 мг 2 раза в день), или нифурател (400 мг 2 раза в день) +
- висмута трикалия дицитрат (120 мг 4 раза в день или 240 мг 2 раза в день).
4) Четвертый вариант. Если пожилым больным невозможна полноценная эрадикационная терапия, применяют усечённые схемы:
- один из ИПН в «стандартной дозировке» +
- амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) +
- висмута трикалия дицитрат (120 мг 4 раза в день или 240 мг 2 раза в день).
Другой способ: висмута трикалия дицитрат по 120 мг 4 раза в день в течение 28 дней. При наличии болей в области желудка — короткий курс ИПН.
Эрадикация инфекции Helicobacter pylori при использовании тройной терапии первого выбора
Введение
Маастрихтский консенсус — III 2005 г. подтвердил необходимость проведения эрадикации инфекции у больных Helicobacter pylori
ассоциированными гастродуоденальными язвами. Уничтожение хеликобактерной инфекции дает шанс излечить заболевание, то есть исключить рецидивы язвы в будущем. В качестве
терапии первого выбора
в течение 7-14 дней следует использовать следующий протокол: ингибитор протонной помпы в стандартной дозировке 2 раза в день + кларитромицин 500 мг 2 раза в день + амоксициллин 1000 мг 2 раза в день или метронидазол 500 мг 2 раза в день. При первичной резистентности Helicobacter pylori (H. pylori) к метронидазолу выше 40% этот препарат не рекомендуется использовать в схеме тройной эрадикационной терапии.
Проведенные в России исследования показали, что первичная резистентность к метронидазолу превышает 50%
. Можно предполагать, что аналогичная ситуация существует и в нашей стране. В Западной Европе, где первичная резистентность к метронидазолу низкая, имеются сообщения о высоком эффекте протоколов тройной терапии с метронидазолом. В последние годы появилось новое производное нитроимидазола —
орнидазол
(дазолик), обладающий преимуществами перед метронидазолом. Фармакокинетические преимущества заключаются в более длительном периоде полувыведения препарата (орнидазол — 13 ч, метронидазол — 7 ч); отсутствии взаимодействия с ферментной системой цитохрома Р450, лучшем проникновении через бактериальную стенку. Орнидазол не вызывает ингибирования ацетальдегидрогеназы и появления дисульфирамоподобных реакций, что позволяет осуществлять прием алкоголя во время лечения. Благодаря этому может возрасти приверженность к фармакотерапии (compliance) и расшириться круг пациентов, у которых может применяться препарат. Имеются сообщения о достаточно высокой частоте эрадикации (85,7%) при использовании протокола с орнидазолом. В нашем регионе эффективность такого протокола не изучалась.
Цель работы
заключалась в сравнительной оценке эффективности протоколов первого выбора лечения инфекции H. pylori: ингибитор протонной помпы + кларитромицин + амоксициллин и ингибитор протонной помпы + орнидазол.
Пациенты и методы исследования
Изучены результаты двух вариантов эрадикационной терапии при рандомизированном проведении исследования у больных Витебской области. Тщательно соблюдались методические правила проведения эрадикации. Всем больным подробно объяснялись цель, задачи, возможные результаты и побочные эффекты эрадикационной терапии, создавалась мотивация проведения лечения. Обследовано и пролечено 47 больных, имеющих инфекцию H. pylori и эрозивные или язвенные поражения желудка и/или двенадцатиперстной кишки. Все пациенты постоянно принимали нестероидные воспалительные препараты. Возраст обследованных составил 22-60 лет.
Определение инфекции H. pylori до лечения осуществлялось при одновременном использовании двух методов диагностики: морфологического исследования гастробиоптата
(окраска гематоксилин-эозином по Гимзе и альциановым синим, 2 гастробиоптата получали из антрального отдела и 2 — из тела желудка) и
быстрого уреазного метода
тест-наборами УП «Семпер» (Республика Беларусь).
Через 8 недель или позже после проведенного эрадикационного лечения, но не ранее чем через 4 недели после прекращения антисекреторной или какой-либо антибактериальной терапии, осуществляли повторную диагностику Н. pylori быстрым уреазным тестом. Успешная эрадикация констатировалась по негативному результату быстрого уреазного теста.
Использованы два варианта эрадикационной терапии
:
- протокол ОКА
— однонедельная тройная терапия (25 больных) наборами препаратов «Пептипак»: 20 мг омепразола, 500 мг кларитромицина и 1000 мг амоксициллина; каждый из препаратов 2 раза в день; - протокол ЛКО
— тройная терапия (22 больных) по следующему протоколу: 30 мг лансопразола, 500 мг кларитромицина и 1000 мг орнидазола; каждый из препаратов — 2 раза в день.
В группе больных, пролеченных по протоколу ЛКО, использовали следующие препараты: орнидазол — «Дазолик» (, Индия), лансопразол («MaxPharma», Кипр); кларитромицин — «Клерон» («MaxPharma», Кипр). В случае протокола ОКА применяли набор препаратов «PeptiPac», в состав которого входит омепразол, кларитромицин и амоксициллин, рассчитанные на одну неделю лечения (, Иерусалим).
Основные анализируемые показатели
при оценке эффективности лечения:
- intention to treat
(ITT) — процентное отношение вылечившихся (избавившихся от хеликобактерной инфекции) пациентов и общего количества пациентов, начавших лечение; - per protocol
(PP) — процентное отношение вылечившихся пациентов и числа тех из них, кто провел лечение в полном объеме в строгом соответствии с протоколом. Учитывались только те больные, которые прошли контрольную эндоскопию; 8 пациентов отказались от повторного обследования, мотивируя отказ отсутствием каких-либо гастроэнтерологических жалоб.
Для оценки различий численных величин применялся непараметрический критерий согласия χ2 для таблиц сопряженности (критерий Пирсона-Фишера).
Результаты и обсуждение
Результаты изучения эрадикации H. pylori приведены в табл. 1. По данным быстрого уреазного теста, при использовании классического протокола первой линии и его модификаций по показателю intention to treat эрадикация достигалась в 84,0-85,7%, per protocol — в 85,7-87,5% случаев. Статистически значимых различий протоколов ОКА и ЛКО не обнаружено (по per protocol χ2 = 0,12; p > 0,1); оба варианта лечения подтвердили свою эффективность.
Таблица 1. Результаты эрадикационной терапии
| Протокол | Количество больных | Частота эрадикации | ||||
| intention to treat | per protocol | |||||
| intention to treat | per protocol | абс. | % | абс. | % | |
| ОКА | 25 | 24 | 21 | 84,0 | 21 | 87,5 |
| ЛКО | 14 | 14 | 12 | 85,7 | 12 | 85,7 |
Шестеро пациентов из 25 отметили следующие побочные эффекты
при использовании протокола ОКА:
- тошнота — 1 чел.,
- горечь и сухость во рту — 1 (у того же больного, у которого имелась тошнота),
- послабление стула (увеличение частоты на 1 раз и/или изменение формы стула до 5-6 типа по Бристольской шкале) — 4,
- выраженная диарея, приведшая к прекращению лечения, — 1 больной.
При использовании протокола ЛКО побочные эффекты
отмечены у 10 из 22 больных, причем эффекты нередко сочетались у одного и того же пациента:
- тошнота — 3,
- однократная рвота — 1,
- горечь во рту — 3,
- сухость во рту — 2,
- послабление стула — 5,
- диарея — 2 случая.
Различия по количеству больных с побочными эффектами в двух группах оказались статистически незначимыми
: χ2 = 1,54; p > 0,05.
Приведенные результаты соответствуют результатам современных западноевропейских и североамериканских рандомизированных исследований, в которых контроль эффективности лечения проводился дыхательным тестом с мочевиной, содержащей 13С. Ранее мы проводили метаанализ публикаций за 5 лет (1997-2002 гг.), посвященных эффективности эрадикационной терапии 3226 больных при использовании схемы ОКА в дозировках, рекомендуемых Маастрихтским консенсусом — II. По результатам метаанализа выяснилось, что среднее значение величины эрадикации intention to treat составило 78,6, per protocol — 83,2%. Полученные результаты существенно отличаются от результатов лечения в начале 1990-х гг., когда эффективность эрадикации составляла 90-98%
. Учитывая, что наше исследование продолжается, возможна корректировка конечных результатов в сторону уменьшения частоты эрадикации, что является более адекватным результатом лечения в наших условиях.
Существует около 50 метаанализов, касающихся проблем эрадикационной терапии. Важной особенностью оценки результатов эрадикационной терапии является строгое соблюдение методических правил. Игнорирование любого из этих правил, например проведение оценки эрадикации на фоне или вскоре после отмены антисекреторной и/или антибактериальной терапии, дает ложноположительные результаты успешной эрадикации и в дальнейшем ошибочную высокую частоту реинфекции. Практическому врачу не следует отступать от общепринятых протоколов лечения, самостоятельно их «совершенствуя».
В соответствии с положениями Маастрихтского консенсуса — III 2005 г., четырнадцатидневная продолжительность лечения на 12% более эффективна, чем семидневная
(95%-й доверительный интервал 7-17%). Семидневная терапия может использоваться в тех случаях, когда местные исследования показали ее эффективность. Протокол ингибитор протонной помпы-кларитромицин-амоксициллин или метронидазол рекомендуется в качестве терапии первого выбора в популяциях с резистентностью к кларитромицину ниже 15-20%. В популяциях с резистентностью к метронидазолу ниже 40% предпочтение следует отдавать протоколу ингибитор протонной помпы-кларитромицин-метронидазол. Квадротерапия является возможной альтернативой в качестве протокола первого выбора. Последнее положение является новым с точки зрения нормативной констатации, хотя ранее оно и использовалось в практике.
Неэффективность первой линии лечения требует, в соответствии с Маастрихтскими консенсусами II и III, применения протокола второй линии
: ингибитор протонной помпы в стандартной дозе 2 раза в день + субцитрат/салицилат висмута 120 мг 4 раза в день + метронидазол 500 мг 3 раза в день + тетрациклин 500 мг 4 раза в день; длительность лечения 7-14 дней. В рекомендациях Маастрихтского консенсуса — III 2005 г. о.
Последнее положение по лечению на уровне второй линии нельзя считать полностью обоснованным. Наблюдается возврат к протоколу ингибитор протонной помпы-амоксициллин-метронидазол, отвергнутому Маастрихтом — II. Правда, ранее речь шла об использовании этой комбинации в качестве первой линии терапии. Рекомендовать протокол ингибитор протонной помпы-амоксициллин-метронидазол в нашей популяции вряд ли целесообразно. В российском рандомизированном мультицентровом исследовании В. Т. Ивашкин с соавторами изучили уровень эрадикации при использовании омепразола (20 мг 2 раза в день) + амоксициллин (1000 мг 2 раза в день) + метронидазол (400 или 500 мг 2 раза в день) и получили крайне низкую частоту эрадикации — 30%
(95%-й доверительный интервал 17-43%).
При рекомендации протокола ингибитор протонной помпы-амоксициллин-метронидазол в материалах консенсуса приводится ссылка всего лишь на одно рандомизированное исследование. Примечательно, что в следующей цитируемой в консенсусе работе частота эрадикации при использовании вышеупомянутой схемы составила 57%, а уровень резистентности к метронидазолу равнялся всего лишь 30%. Эти данные подтверждают, что у нас использование такого протокола лечения даст еще меньший эффект. При использовании эрадикационного протокола ингибитор протонной помпы-тетрациклин-метронидазол применяется ингибитор протонной помпы в стандартной дозе 2 раза в день + метронидазол 500 мг 2 раза в день + тетрациклин 500 мг 4 раза в день. Вряд ли целесообразно применять этот протокол в нашей популяции без достоверных данных (рандомизированных исследований) об эффекте лечения в условиях, близких к нашим, хотя бы по инфицированности и первичной антибактериальной резистентности. Упоминаемая в материалах консенсуса «недоступность» препаратов коллоидального висмута связана с запретом на их применение в отдельных странах.
При неэффективности второй линии эрадикации используют лечение третьей линии
(«третьего выбора»). Как отмечено в материалах последнего консенсуса, «лечение третьего выбора должно основываться на определении чувствительности H. pylori к антибактериальным препаратам». В наших условиях на сегодняшний день это невозможно. За рубежом в качестве одного из препаратов протокола третьего выбора иногда включают левофлоксацин или рифабутин. Обычно используется левофлоксацин (500 мг 2 раза в день) + ингибитор протонной помпы (в стандартной дозе 2 раза в день) + амоксициллин (1000 мг 2 раза в день) при тройной терапии, длительность 7 или 10 дней. Частота эрадикации per protocol такого лечения, по данным систематизированного обзора, составляет 63-86%. По экономическим соображениям использование протоколов с левофлоксацином в массовом порядке у нас вряд ли нецелесообразно.
Что делать при безуспешности эрадикации после применения тройной терапии первой линии и квадротерапии в качестве второй линии? Один из ведущих экспертов консенсуса, секретарь Европейской группы по изучению H. pylori (EHSG), профессор F. Megro дает ряд рекомендаций в одной из своих статей. Наше рандомизированное исследование и повседневный клинический опыт подтверждают правомочность таких рекомендаций и несколько их дополняют.
Итак, при неэффективности предшествующего лечения
следует выбрать отличающийся по комбинации антибиотиков вариант тройной терапии и удлинить время лечения до 2 нед. Возможно использование нового варианта квадротерапии из числа рекомендованных. Еще одним путем повышения эффективности эрадикации является замена ингибитора протонной помпы на более действенный. Для нашей страны проблема надежного дженерика имеет первостепенное значение. На время лечения следует посоветовать пациенту
прием кефира или йогурта
, содержащего бифидо- и лактобактерии. Это предупредит развитие антибиотико-ассоциированной диареи, которая изредка становится причиной отказа от лечения. Известны данные, что включение в комплекс лечения
Lactobacillus acidophilus, Lactobacillus gasseri, Saccharomyces boulardii и Bifidobacterium
улучшает результаты эрадикации. Не следует забывать о приверженности больного фармакотерапии. Заранее следует оговорить с пациентом необходимость воздержания от алкоголя, поскольку в случае несоблюдения этого условия невозможен прием метронидазола или фуразолидона. Доказано, что
курение
ассоциировано со сниженным эффектом от эрадикации.
Заключение
По данным уреазного теста, при проведении однонедельной тройной эрадикационной терапии первой линии по протоколу ингибитор протонной помпы-кларитромицин-орнидазол
эрадикация наступает у 85,7% пациентов, осуществивших лечение в полном объеме, а при использовании протокола
ингибитор протонной помпы-кларитромицин-амоксициллин
— у 87,5% пациентов, что подтверждает достаточную эффективность обоих протоколов лечения.
Пиманов С. И., Макаренко Е. В., Овчинников В. В., Кавцевич М. Л., Королева Ю. И., Семенова Е. В., Сапего Л. Г.
Витебский государственный медицинский университет, Витебская областная клиническая больница. Опубликовано: «Медицинская панорама» № 5, апрель 2008.
Возможные осложнения от лечения антибиотиками
Факторы, повышающие риск появления побочных эффектов при проведении эрадикционной терапии:
- Индивидуальная непереносимость препаратов;
- Наличие соматических патологий;
- Негативное состояние микрофлоры кишечника в начальный период лечения.
Осложнения эрадикционной терапии – побочные действия:
- Аллергическая реакция на компоненты препаратов, исчезающая после отмены;
- Диспепсические явления ЖКТ (дискомфорт в желудке и кишечнике, привкус горечи и металла, тошнота и рвота, диарея, метеоризм). Обычно все эти явления самопроизвольно проходят спустя короткое время. В редких случаях (5-8 %) врач назначает средства против рвоты или диареи, или отменяет курс.
- Дисбактериоз. Чаще проявляется у пациентов, ранее имевших нарушения функции ЖКТ, развивается при лечении препаратами тетрациклинового ряда или при терапии макролидами. Кратковременный курс не способен нарушить баланс микрофлоры кишечника, для профилактики дисбактериоза нужно чаще употреблять кисломолочную продукцию: йогурт, кефир.
Питание и диета
Безусловно, основным пунктом при лечении данной патологии выступает прием медицинских препаратов, но не менее важную роль играет правильное питание. Чтобы легко избавиться от хеликобактериоза, следует соблюдать следующие рекомендации:
- не делать больших интервалов между приемами пищи;
- употреблять пищу небольшими порциями;
- соблюдать 5-6 разовый режим питания, есть при этом нужно медленно, хорошо пережевывая еду и запивая ее достаточным количеством жидкости;
- пациенту следует отказаться от чересчур жирной, жареной или острой пищи, газированных напитков, маринованных блюд, алкоголя.
В действительности это только общие рекомендации, в каждом отдельном случае питание должно рассчитываться исходя из уровня кислотности (пониженная, повышенная) и назначаться только специалистом, проводящим лечение.
Профилактика
Полностью вылечиться от хеликобактериоза можно, если помимо терапии придерживаться профилактических мер:
- Соблюдение гигиены. Мыть руки перед приёмом пищи, не употреблять грязные овощи и фрукты, сомнительную воду. Не использовать чужие предметы обихода.
- Своевременное обнаружение болезни. При плохом самочувствии или подозрении на присутствие в организме патогенной бактерии важно немедленно обратится к врачу, пройти нужные тесты.
- Укрепление иммунитета. Здоровый образ жизни (плаванье, бег, пешие прогулки) повышает защитные силы и препятствует проникновению болезнетворных микробов в организм.
- Правильное питание. Дробный приём пищи, малые дозы и отказ от жареного, солёного, острого, копчёного, алкоголя и курения.
Основная опасность helicobacter pylori в том, что она может спровоцировать гастрит, язву даже новообразования злокачественного характера. От вредоносных бактерий невозможно избавиться без антибиотиков. Поэтому важно строго придерживаться специальных схем лечения и соблюдать профилактические меры.